关键词 |
消毒产品卫生许可证代办 |
面向地区 |
全国 |
消毒剂消毒产品卫生许可证代办:
(一) 粉剂消毒剂。
(二) 片剂消毒剂。
(三) 颗粒剂消毒剂。
(四) 液体消毒剂。
(五) 喷雾剂消毒剂。
(六) 凝胶消毒剂。
对于有净化要求的,在相应类别后注明“(净化)”。
消毒产品卫生许可证代办目录
卫生用品
(一) 卫生巾、卫生护垫。
(二) 卫生栓(内置棉条)。
(三) 尿裤。
(四) 尿布(垫、纸)。
(五) 隔尿垫。
(六) 湿巾、卫生湿巾。
(七) 抗(抑)菌制剂(栓剂、皂剂除外)(注明具体剂型)。
(八) 隐形眼镜护理液。
(九) 隐形眼镜保存液。
(十) 隐形眼镜清洁剂。
(十一) 纸巾(纸)。
(十二) 卫生棉(棒、签、球)。
(十三) 化妆棉(纸、巾)。
(十四) 手(指)套。
(十五) 纸质餐饮具。
对于有净化要求的,在相应类别后注明“(净化)”。
消毒产品卫生许可证代办:厂区环境与布局要求
厂区选址卫生要求:
(一)与可能污染产品生产的有害场所的距离应不少于30米。
(二)消毒产品生产企业不得建于居民楼。
(三)厂区周围无积水、无杂草、无生活垃圾、无蚊蝇等有害医学昆虫孳生地。
第四条 厂区环境整洁。厂区非绿化的地面、路面采用混凝土、沥青及其他硬质材料铺设,便于降尘和清除积水。
第五条 厂区的行政、生活、生产和辅助区的总体布局应合理,生产区和生活区应分开。
第六条 厂区应具备生产车间、辅助用房、质检用房、物料和成品仓储用房等,且衔接合理。
第七条 厂区的生产和仓储用房应有与生产规模相适应的面积和空间。生产车间使用面积应不小于100平方米,其中分装企业生产车间使用面积应不小于60平方米;生产车间净高不低于2.5米。
第八条 厂区内设置的厕所应采用水冲式,厕所地面、墙壁、便槽等应采用易清洗、不易积垢材料。
第九条 动力、供暖、空调机房、给排水系统和废水、废气、废渣的处理系统等设施应不影响产品质量。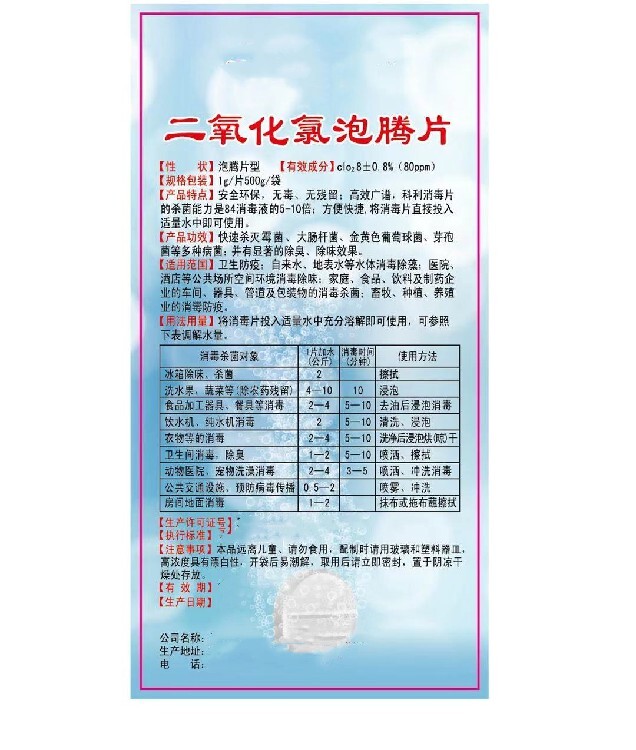
消毒卫生许可证代办
设备要求
第二十条 生产企业应具备适合消毒产品生产特点和工艺、满足生产需要、产品质量的生产设备和检验仪器设备,生产设备应符合本规范附件1的要求。
第二十一条 生产设备的选型、安装应符合生产和卫生要求,易于清洗、消毒,便于生产操作、维修、保养。
生物指示物应采用的生产设备加工、生产。
第二十二条 在生产过程中与物料、产品接触的设备表面应光洁、平整、易清洁、耐腐蚀,且不与产品发生化学反应或吸附作用。
第二十三条 制水设备、输送管道和储罐的材质应、耐腐蚀。管道应避免死角、盲管。
纯化水等生产用水在制备、储存和分配过程中要防止微生物的滋生和污染。
第二十四条 使用、维护和保养设备所用的材料不应对产品和容器产生污染。
第二十五条 根据产品不同的卫生要求,对在生产过程中使用的管道、储罐和容器应定期清洗、消毒或灭菌。
第二十六条 生产和检验的设备应由专人管理,并定期维修、保养、校验,记录备查。
第二十七条 用于生产和检验的仪器、仪表、量具、衡器等,其适用范围和精密度应符合生产和检验要求,应有合格标志,计量器具根据国家规定定期检定。不合格的设备应移出生产区,未移出前应有明显标志。
第二十八条 分装企业可以根据具体情况适当调整生产设备。
消毒产品卫生许可证
卫生质量管理要求
生产企业法定代表人(负责人)或授权负责人对产品质量和本规范的实施负责。
灭菌剂、皮肤粘膜消毒剂(用于洗手的皮肤消毒剂除外)、化学(生物)指示物、隐形眼镜护理用品生产企业应设置卫生质量管理部门,负责对产品生产全过程的卫生质量管理。
其他消毒产品生产企业应设立专兼职卫生管理员,负责对产品生产全过程的卫生质量管理。
第三十七条 生产企业应建立和完善消毒产品生产的各项标准操作规程和管理制度。
管理制度包括:人员岗位责任制度、生产人员个人卫生制度、设备采购和维护制度、卫生质量检验制度、留样制度、物料采购制度、原材料和成品仓储管理制度、销售登记制度、产品投诉与处理制度、不合格产品召回及其处理制度等。
第三十八条 生产企业同一生产线生产相同工艺不同产品时,应制定生产设备和容器的操作规程、清洁消毒操作规程和清场操作规程。
第三十九条 生产企业应建立健全并如实记载生产过程的各项记录,包括物料采购验收记录、设备使用记录、批生产记录、批检验记录、留样记录等内容。
各项记录应完整,溯源,不得随意涂改,妥善保存至产品有效期后3个月。
第四十条 生产企业应按本规范要求建立与其生产能力、产品自检要求相适应的卫生质量检验室。根据产品特点和出厂检验项目的要求设置理化和/或微生物检验室。
微生物检验室应符合实验室设置的有关要求,并满足出厂检验项目的需要。
对有特殊要求的仪器、仪表,应安放在的仪器室内,其室内温度、相对湿度、静电、震动等环境因素应能满足仪器的特殊要求。
第四十一条 消毒剂、抗(抑)菌制剂有效成分含量检测需要使用气相色谱、液相色谱等仪器设备的,可委托通过计量认证的检验机构进行检验。
第四十二条 生产企业应根据产品特点对产品卫生质量进行自检,不同产品出厂检验项目应符合下列要求:
(一)消毒器械生产企业应对每个产品消毒作用因子强度进行检测;无特定消毒作用因子强度检测方法的消毒器械生产企业,应建立能该产品质量的相应技术参数、检测指标及方法,并对每个产品进行检测。
(二)化学(生物)指示物生产企业应建立能该产品质量的相应技术参数、检测指标及方法,并对每个投料批次产品进行检测。
(三)消毒剂、抗(抑)菌制剂生产企业应对每个投料批次产品的pH值、有效成分含量、净含量和包装密封性进行检测;无特定有效成分含量检测方法的皮肤粘膜消毒剂、灭菌剂、抗(抑)菌制剂不能进行有效成分含量检测的,应作pH值、相对密度、净含量和包装密封性指标测定。
(四)隐形眼镜护理用品生产企业应根据产品质量特点对每个投料批次生产的产品按照《隐形眼镜护理液卫生要求》(GB19192)进行理化指标、微生物污染指标和细菌、霉菌等消毒效果指标检测;无特定有效成分含量检测方法的,应对有效成分含量除外的其他理化指标进行检测。
(五)其他一次性使用卫生用品生产企业应当对每个投料批次的产品进行微生物指标和包装完整性检测,湿巾还应进行包装密封性检测,卫生湿巾还应进行有效成分含量、包装密封性检测。
生产企业有微生物检验条件的可以接受其分装企业、另设分厂(车间)的委托,对产品微生物指标进行检验。
生产企业无微生物检验条件的应委托通过计量认证的检验机构对产品微生物指标进行检验。
纸杯的批次还应符合《纸杯》(QB 2294)的规定。
第四十三条 每批产品投放市场前应按本规范的自检项目和产品企业标准出厂检验进行卫生质量检验,合格后方可出厂。企业标准中的卫生指标及其检验方法应符合国家有关卫生标准、技术规范和规定的要求。
第四十四条 有净化要求的生产企业应对净化车间进行以下项目检测:温度、相对湿度、进风口风速、室内外压差、空气中≥0.5μm和≥5μm尘埃粒子数、工作台表面、装配与包装车间空气细菌菌落总数。
有净化要求的卫生用品生产企业应对生产车间工人手表面进行细菌菌落总数和致病菌检测,并有检验报告。
其他卫生用品生产企业应对生产车间的工作台表面、生产车间空气细菌菌落总数,工人手表面细菌菌落总数和致病菌进行检测,并有检验报告。

消毒产品卫生许可证代办
复配消毒液
1.称量装置
2.配料装置
3.反应装置
4.储存装置
5.灌装设备
6.水处理装置(外购生产用水除外)
7.打码设备
8.包装设备(封口机/旋盖机、打包机)
